Praca jest podsumowaniem wiedzy o działaniu biologicznym i leczniczym taksyfoliny, otrzymywanej w sposób naturalny. Jej szczególnie silne właściwości antyoksydacyjne są obecnie przedmiotem wielu badań. Praca przedstawia dostępne preparaty taksyfoliny i ich zastosowanie.
Właściwości, działanie lecznicze i zastosowanie taksyfoliny
dr n.farm. CECYLIA MIELCZAREK & dr n.farm. DOROTA KUSZTAL
Zakład Chemii Analitycznej, Katedra Chemii Medycznej Wydziału Farmaceutycznego Uniwersytetu Medycznego w Łodzi
Ta praca była finansowana przez wewnętrzny grant z Uniwersytetu Medycznego w Łodzi, Polska: 503/3-016-03/503-01
© Polish Journal of Cosmetology 2013, 16(1): 24-30
Nadesłano: 26.11.2012
Zakwalifikowano do druku: 15.02.2013
Adres do korespondencji
Cecylia Mielczarek
Department of Analytical Chemistry Department of Chemistry
Medical Faculty of Pharmacy Medical University
ul. Muszynski 1, 90-151 Łódź, cecylia.mielczarek@umed.lodz.pl
Słowa kluczowe: taksyfolina, antyoksydant, flawanon
Wprowadzenie
Od początku lat 1990 Taksyfolina była sprzedawana jako suplement diety w Federacji Rosyjskiej, Szwajcarii i Stanach Zjednoczonych. Ponadto, w Federacji Rosyjskiej przez ponad dekadę taksyfolina była stosowana jako dodatek do żywności w nabiale, mięsie i wyrobach cukierniczych, w oleju i tłuszczach, oraz w napojach alkoholowych i bezalkoholowych.
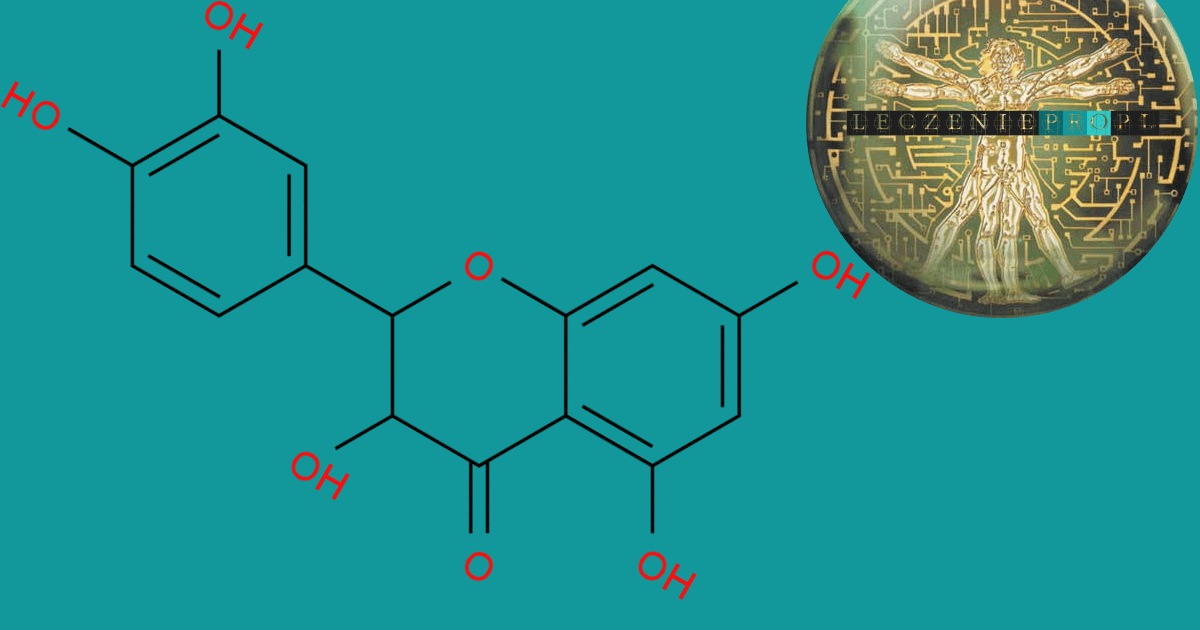
Taksyfolina to popularny i rozpowszechniony flawanon, którego struktura chemiczna jest zbliżona do struktury kwercetyny (flawon). Nomenklatura IUPAC: (2R,3R)-2-(3,4-dihydroksyfenylo)-3,5,7-trihydroksy-2,3-dihydro-4H-chromen-4-on.
Istnieje wiele synonimów tego związku, np. (2R,3R)-2-(3,4-dihydroksyfenylo)-3,4,7-trihydroksy-2,3-dihydroksychromen-4-on-4-on, 2R-trans)-2-(3,4-dihydroksyfenylo)-2,3-dihydro-3,5,7-trihydroksy-4-benzopiron,3,3′,4’,5,7-pentahydroksyflawonon, 2,3- dihydro-3,3′,4′,5,7-pentahydroksyflawon. 2-(3,4- dihydroksyfenylo)-2,3-dihydro-3,5,7-trihydroksy-4H-1-Benzopiran-4-on, (2R,3R)-, 2,3-Dihydrokwercytyna, hydrat Katechiny, Distylina, Lariksina, Lawitol, Taksyfoliol.
Istnieją dwa różne diastereomery taksyfoliny, 2R3R-trans i 2R3S-cis. Forma trans taksyfoliny dominuje w przyrodzie [1] (2R,3R)-2-(3,4-dihydroksyfenyl)-3,5,7-trihydroksy-2,3-dihydro-4H-chromen-4-on
Właściwości fizyczne i chemiczne, występowanie i otrzymywanie taksyfoliny
Taksyfolina to biały (do blado-żółtego) proszek, stosunkowo łatwo rozpuszczalny w wodzie i alkoholu w porównaniu z innymi flawonoidami. Rozpuszczalność taksyfoliny w wodzie w różnych temperaturach ma charakter wykładniczy: w temperaturze pokojowej rozpuszczalność wynosi 0.1%; w temperaturze 40 °C – 0.3%; w temperaturze 60 °C – 1.0%; w temperaturze 90 °C – 3-5.3%. Rozpuszczalność taksyfoliny jest bezpośrednio związana z temperaturą roztworu octanu etylu. Tak więc, w temperaturze 20 °C, rozpuszczalność taksyfoliny wynosi 1.90%; w temperaturze 40 °C jest bliska 9 do 12%; i w temperaturze 70 °C wynosi około 28%. Taksyfolina jest nierozpuszczalna w chloroformie i benzenie [2,3].
Powinna być przechowywana w chłodnym, suchym miejscu, z dala od światła i innych substancji chemicznych. Temperatura topnienia taksyfoliny wynosi 234-236 °C [1]. Generalnie taksyfolina z drewna modrzewiowego powinna być przechowywana w suchych, czystych, dobrze wentylowanych pomieszczeniach, bez obcych zapachów. Należy trzymać ją z dala od wilgoci i promieni słonecznych. Powinna być przechowywana w temperaturze 2-4 °C i wilgotności w zakresie od 40 % do 60 % [1]
Taksyfolina jest otrzymywana z korzeni i dolnej części syberyjskiego modrzewia (Larix sibirica), który rośnie na Syberii i rosyjskim Dalekim Wschodzie (na obszarze Amur). W Finlandii, pomimo podobnego materiału, czysta taksyfolina nie została otrzymana w dużych ilościach. Tylko Rosjanie zdołali uzyskać najczystszą taksyfolinę, ale proces jej otrzymywania jest chroniony patentem. Dokumenty patentowe opublikowane są w Federacji Rosyjskiej, natomiast proces omówiony został w patencie Stanów Zjednoczonych #5756098 i patencie europejskim (European Patent) EP2307005A1. Wiadomo, że modrzew poddaje się wstępnej modyfikacji drewna, ekstrakcji, delignifikacji, procesom katalitycznego utleniania i hydrolizy tak, że otrzymuje się z modrzewia dodatkowo ligninę i celulozę [1].
Gotowy ekstrakt taksyfoliny z drewna modrzewiowego, o wilgotności nie większej niż 10% i zawartości taksyfoliny nie mniejszej niż 88%, jest sortowany i pakowany. Największa zawartość taksyfoliny występuje w dolnej części pnia modrzewia, która była klasyfikowana jako odpad i spalana na miejscu.
Pod koniec XX wieku przetwórstwo drewna wprowadzono na skalę przemysłową. Taksyfolina występuje w dużych ilościach w roślinach użytkowych, w szczególności w drewnie drzew iglastych, takich jak świerk, sosna albo modrzew. W małych ilościach występuje w owocach cytrusowych i nasionach bawełny. W Polsce taksyfolina jest obecna w małych ilościach w Serum reflexum L [4]. (czy Sedum reflexum L. – Rozchodnik ościsty ?)
Właściwości biologiczne i wynikające z nich właściwości lecznicze taksyfoliny.
W rosyjskiej medycynie ludowej taksyfolinę stosowano już dawno temu. Jednak badania naukowe wykazały tylko relatywną podstawę dla jej praktycznego wykorzystania.
Wstępne badania wykazały przeciwzapalne właściwości taksyfoliny, inne wykazały silną moc antyoksydacyjną często przy nadmiarze witamin A, C i E. [5, 6]. Wyniki badań prowadzą do wniosku, że taksyfolina:
- Inaktywuje substancje cytotoksyczne [7]
- Redukuje ilość i gęstość lipoprotein w wątrobie i we krwi [5, 6, 8, 9]
- Chroni przed szkodliwym działaniem promieniowania jonizującego [6, 10]
- Normalizuje układu enzymatyczny komórek [11]
- Ponadto, wykazuje działanie:
- Jako substancje czynne [12, 13]
- Przeciwrodnikowe i chroniące lipidy przed utlenianiem [5, 6, 8, 9]
- Przeciwnowotworowe [14, 15]
- Antymutagenne [16-19]
- Przeciwwirusowe [20]
- Antyalergiczne [21]
Taksyfolina o działaniu silnie antyoksydacyjnym jest niezwykle ważna ze względu na choroby, które wywoływane są przez wolne rodniki [22].
Wolne rodniki w reakcji z innymi cząsteczkami mogą tworzyć inne struktury, ale i tak pozostają bardzo reaktywnymi wolnymi rodnikami, które dalej reagują tworząc kolejne rodniki. W ten sposób zachodzi reakcja łańcuchowa, prowadząca do wytworzenia dużej ilości wysoce reaktywnych cząsteczek niebezpiecznych dla organizmu. Rodniki reagują ze strukturami biologicznymi, co z kolei prowadzi do ich uszkodzenia. Im więcej jest wolnych rodników w organizmie, tym większy jest efekt destrukcyjny interferencji na wewnętrzną równowagę organizmu.
W związku z działaniem wolnych rodników zaburzone są funkcje życiowe komórek, prowadząc do zmiany ich metabolizmu i wejścia komórek w fazę przedwczesnego starzenia. Wpływ wolnych rodników w organizmie może być widoczny dopiero po pewnym czasie. Rezultatem jest nie tylko gwałtowne starzenie się organizmu, ale także różne schorzenia, takie jak na przykład miażdżyca tętnic i zapalenie stawów, wynikające z zaburzeń funkcji życiowych komórek. Uszkodzenia kwasu nukleinowego w komórkach mogą nawet prowadzić do zwiększenia podatności organizmu na rozwój nowotworów. Wolne rodniki powodują również obniżenie odporności.
Występujące w przyrodzie związki, które po dodaniu jednego elektronu nie tworzą rodników to antyoksydanty lub przeciwutleniacze. Reakcja z niereaktywnymi rodnikami tworzy cząsteczkę, tym samym hamując reakcję łańcuchową wolnych rodników.
Antyoksydanty mają powinowactwo do poszczególnych rodzajów wolnych rodników. Związki te obejmują między innymi witaminy C i E, tokoferole, retinoidy. Obecność wolnych rodników w organizmie jest spowodowana nie tylko zanieczyszczeniem środowiska, dymem tytoniowym, działaniem promieni słonecznych, lecz także nieodpowiednią dietą, stresem i alkoholem.
Idealnym rozwiązaniem byłoby unikanie sytuacji i czynników, które przyczyniają się do powstawania wolnych rodników, ale obecnie jest to bardzo trudne. Organizm ludzki wytworzył serię reakcji obronnych. Istnieją pewne mechanizmy enzymatyczne i nieenzymatyczne, w naszym organizmie, służące do neutralizacji wolnych rodników.
Najskuteczniejszym sposobem walki z wolnymi rodnikami jest dostarczenie organizmowi inhibitorów reakcji wolnych rodników, takich jak antyoksydanty (przeciwutleniacze).
Antyoksydanty występują w olejach roślinnych, orzechach, nasionach słonecznika, soi, nasionach sezamu, kiełkach pszenicy, owocach – czarnej porzeczki, ciemnych winogron, dzikiej róży, jabłka, aronii, i warzywach (marchwi, pietruszce, brokułach, papryce, kapuście, pomidorach). Teoretycznie prosta, pełnowartościowa dieta odpowiednia dla organizmu może pomóc zneutralizować szkodliwe składniki.
Młody organizm sam walczy z procesem, wytwarzając przeciwutleniacze do zwalczania wolnych rodników. Przyjmowanie produktów spożywczych bogatych w przeciwutleniacze z upływem czasu staje się jednak niewystarczające. Jeśli organizm jest starszy lub częściej narażony na stres, złe odżywianie i zanieczyszczenie środowiska trudniej jest mu walczyć z nadmiarem wolnych rodników i liczba przeciwutleniaczy produkowanych przez organizm zmniejsza się. Prowadzi to do zakłócenia równowagi organizmu, a tym samym do zwiększonej podatności na choroby. Idealnym rozwiązaniem jest wprowadzenie do organizmu szerokiej gamy antyoksydantów, które inhibitują wiele rodzajów wolnych rodników.
Stwierdzono, że taksyfolina wzmacnia układ odpornościowy i pomaga w leczeniu nowotworów i powikłań związanych z AIDS. Chroni DNA komórek, a tym samym wzmacnia organizm, reguluje metabolizm, zwiększa syntezę kolagenu [14 , 15 , 23, 24]. Wykazano, że leczy hemoroidy, sklerozę tętnic, ma działanie przeciwzakrzepowe, zmniejsza lepkość krwi, stabilizuje naczynia włosowate, poprawia wydajność i chroni serce przed wpływem oksydacyjnego stresu erytrocytów [5 , 25].
Działa ochronnie na wątrobę, poprawia oddychanie i poprawia biomechanikę pracy oskrzeli [5 , 20, 26].
Taksyfolina jest pomocna w leczeniu cukrzycy, hamując aktywność reduktazy aldozowej, która przekształca glukozę w sorbitol tak, że akumulacja sorbitolu ulega redukcji w czerwonych komórkach krwi [27].
Te właściwości umożliwiają wielokierunkowe zastosowanie flawanoli także jako terapii wspomagającej w leczeniu różnych chorób. Ich wpływ na funkcjonowanie prawie każdego narządu wewnętrznego jest już poznany. Na przykład, badania wykazały, że włączenie taksyfoliny do leczenia nadciśnienia i arytmii serca zwiększyło skuteczność leczenia i znacząco obniżyło poziom cholesterolu.
Taksyfolina może być stosowana jako dodatek do preparatów roślinnych w profilaktyce i leczeniu cukrzycy, wątroby i pęcherzyka żółciowego, prostaty, przewodu pokarmowego, nerek i chorób sercowo-naczyniowych oraz pęcherza moczowego. Może być także stosowana w profilaktyce i leczeniu stanów patologicznych powodowanych przez AIDS, raka, choroby autoimmunologiczne, przewlekłe zapalenia wirusowe i bakteryjne. W przemyśle kosmetycznym dodawana jest do kremów, maści i aerozoli w celu ochrony skóry przed rodnikami, a poprzez zwiększenie syntezy kolagenu skutecznie ujędrnia skórę i redukuje powstawanie zmarszczek.
Stosowana w pastach do zębów, kroplach do oczu, perfumach i wodzie kolońskiej stabilizuje procesy ochronne, wchłaniając się przez skórę, błony śluzowe do krwiobiegu i układu limfatycznego [3].
W Rosji odnotowano szeroką gamę produktów zawierających taksyfolinę: 104 rodzaje suplementów i produktów medycznych zawierających substancje biologicznie aktywne, 46 rodzajów żywności oraz 25 rodzajów kosmetyków.
Stwierdzono, że taksyfolina nie może być syntetyzowana przez zwierzęta, ale jest wymagana w karmach dla zwierząt, gdyż jej brak może prowadzić do wystąpienia chorób takich, jak BSE (bydlęcej encefalopatii gąbczastej, powszechnie znanej jako “choroba szalonych krów”) i innych.
Badania kliniczne taksyfoliny potwierdziły jej doskonałe właściwości w leczeniu:
- Utraty ogólnej odporności
- Choroby układu krążenia
- Choroby płuc i oskrzeli
- Miażdżycy tętnic i wieńcowej choroby serca
- Choroby oka
- Cukrzycy
- Choroby skóry
- Choroby popromiennej
- Choroby nerwowej
- Układu sercowo-naczyniowego
- Zwalczaniu złego cholesterolu
- Podatności na nadużycia i narkotyki
- Niewydolności wątroby i nerek
- Alergii
Ze względu na właściwości lecznicze, dzięki zawartości taksyfoliny, rurkę kapilarną (capillary tube) można stosować jako samodzielną terapię, a także razem z inną terapią w celu zwiększenia jej skuteczności. Badanie wykazało, że włączenie taksyfoliny do leczenia zaburzeń rytmu mięśnia sercowego zwiększyło skuteczność leczenia do 86.7% [29]. Dodatkowo zapobiega stanom zapalnym, obrzękom, obniża poziom cholesterolu i tworzenia płytek krwi oraz zmniejsza krzepliwość krwi.
- Jako środek profilaktyczny, opóźniający procesy starzenia się, redukujący zmęczenie i obniżenie odporności. | Regeneruje funkcje fizjologiczne naczyń włosowatych.
- W przypadku przewlekłego niedotlenienie mięśnia sercowego, dławicy piersiowej, niewydolności serca i zaburzenia rytmu serca należy stosować jako terapię dodatkową, wraz z innymi środkami antyretrowirusowymi w ciągu całego okresu leczenia. | Wzmacnia działanie głównych dróg leczenia wskutek poprawy w dostarczaniu produktów odżywczych do każdej komórki. Zmniejsza krzepliwość krwi, zwiększa częstość akcji serca, stabilizuje rytm serca.
- Stosowanie taksyfoliny podczas całego okresu leczenia, dodatkowo z terapią innymi lekami w celu zwiększenia ich skuteczności. | Poprawia mikrokrążenie kapilarne, długoterminowo obniżając ciśnienie krwi – zmniejsza prawdopodobieństwa nawrotu.
- W ostrych przypadkach, takich jak udar, zawał serca, zapalenie płuc, zapalenie oskrzeli, niewydolność nerek. | Regeneruje mikrokrążenie, poprawia drenaż metabolitów w uszkodzonych narządach i stabilizuje metabolizm komórek.
- Podczas rehabilitacji po wylewach lub zawałach serca należy stosować do całkowitego wyzdrowienia. | Normalizuje przenikalność kapilarną, co prowadzi do redukcji zmian dystroficznych i miażdżycowych w tkankach.
- W przypadku patologii oskrzelowo-płucnej, zapalenia płuc, przewlekłego zapalenia oskrzeli i tchawicy należy stosować razem z innymi lekami w celu zwiększenia ich skuteczności podczas całego okresu leczenia. | W rezultacie zwiększa się pojemność płuc i szybko zanika stan zapalny i obrzęk oskrzeli.
- W przypadku silnego bólu głowy, migreny, nerwicy związanych ze skurczami naczyń krwionośnych. W razie potrzeby preparat może być dodatkowo przyjmowany co 2-3 godziny. | Następuje szybka regeneracja mikrokrążenia krwi, co poprawia procesy metaboliczne w komórkach mózgu.
- W przypadku stanu zapalnego, miażdżycy, niewydolności oczu należy stosować w ciągu całego okresu leczenia. | Taksyfolina wzmacnia i poprawia przewodność nerwu wzrokowego, zwiększa ostrość widzenia, przyspiesza redukcję skutków udaru mózgu.
- W celu wzmocnienia efektów fizjoterapii, w tym laseroterapii, magnetoterapii, terapii światłem należy stosować na 2 godziny przed każdym zabiegiem.
- W przypadku substancji toksycznych, aktywnego i biernego palenia należy stosować nieprzerwanie lub podczas działania toksycznego. | Poprzez wzmocnienie mikrokrążenia krwi w płucach poprawia oddychanie. W rezultacie pobudza usuwanie substancji toksycznych z pęcherzyków płucnych.
Przeciwwskazania
Po wielu latach badań ustalono przeciwwskazania kliniczne. Należy pamiętać jednak, że pacjenci przed planowaną operacją dentystyczną lub inną interwencją o charakterze inwazyjnym powinni zaprzestać na dwa tygodnie przed zabiegiem stosowania jakichkolwiek leków ziołowych, które mają działanie przeciwzakrzepowe.
Taksyfolina jest nadal przedmiotem badań w kierunku jej wykorzystania w diecie człowieka [31,32].
Taksyfolina w ACNFP
Ponieważ każdy nowy produkt spożywczy może być wprowadzony na rynek europejski, musi on jednak wcześniej przejść przez ścisłą kontrolę bezpieczeństwa. W Wielkiej Brytanii kontrola nowych produktów żywnościowych prowadzona jest przez niezależną komisję składającą się z naukowców powoływaną przez Agencję ds. Standardów w Żywności (Food Standards Agency), Komitet Doradczy ds. Nowej Żywności i Procesów (Advisory Committee on Novel Foods and Processes, ACNFP).
ACNFP zakończyła już analizę tego nowego składnika w żywności i sformułowała ostateczną wstępną opinię (sierpień 2010). Co najważniejsze, udowodniono bezpieczeństwo taksyfoliny na podstawie wielu badań przeprowadzonych na zwierzętach i ludziach, a dodatkowo poparte jest to przez rozpowszechnione stosowanie taksyfoliny w żywności dla ludzi w krajach poza UE, np. w Rosji i USA.
Taksyfolina z drewna modrzewiowego jest wchłaniana, metabolizowana i wydalana z moczem w ciągu kilku godzin po spożyciu. Produkcja odbywa się zgodnie z wymogami higieny dotyczącymi bezpieczeństwa i wartości odżywczej produktów spożywczych. Surowce i końcowy produkt są testowane według ścisłych wytycznych. Wzmocniona stabilność do ponad 30 tygodni, odpowidająca 5-ciu latom normalnego okresu trwałości, została potwierdzona w badaniach nad stabilnością. Dane przedstawione w tej dokumentacji zdecydowanie potwierdzają zastosowanie taksyfoliny jako nowego składnika w żywności w UE [1].
Badania na ludziach lub zwierzętach dotyczące Wchłaniania, Dystrybucji, Metabolizmu i Wydalania (ADME)
Dwie godziny po podaniu doustnym 300 mg Pycnogenolu w jednej dawce jedenastu zdrowym ochotnikom, taksyfolinę wykryto w osoczu krwi, osiągając maksymalne stężenie w ciągu 8 godzin. Po tym czasie poziom taksyfoliny powrócił do normy, ale nadal mogła być ona wykryta w osoczu po 14 godzinach. Powtórne podawanie Pycnogenolu w dawce 200 mg/dobę przez 5 dni nie spowodowało utrzymania stężenia na stałym poziomie ze względu na metaboliczne procesy degradacji [1]. Ani kwas 3,4-dihydroksyfenylooctowy ani floroglucyna, bakteryjne metabolity taksyfoliny, nie zostały wykryte w osoczu ochotników.
Dystrybucja taksyfoliny po pojedynczym podaniu była badana na samcach szczurów o masie ciała równej 200 ± 20 g. Taksyfolina była podawana doustnie w dawce 12.5 mg/kg, 25.0 mg/kg, i 50.0 mg/kg oraz dożylnie w dawce 50 mg/kg (roztwór 0.25 % -80 w wodzie). Taksyfolina nadal była obecna w surowicy krwi i nerkach po 6 godzinach, w mięśniu sercowym w 4 godziny po podaniu, oraz w mózgu i mięśniach szkieletowych jeszcze 2 godziny po podaniu. W ciągu 0,5 godziny od podania taksyfolina osiągnęła maksymalne stężenie w osoczu krwi (7.32 mg/ml ) oraz w narządach (7.68 µg/ml w nerkach i 0.17 µg/ml w mięśniach szkieletowych). Niskie stężenie taksyfoliny w umiarkowanie unaczynionych organach wskazuje na niską przepuszczalność i dystrybucję taksyfoliny w tych narządach. Z drugiej strony, wysoka koncentracja taksyfoliny w nerkach może być wyjaśniona przez fakt, że nerki stanowią główny narząd wydalania [1].
Analiza HPLC moczu ochotników przed i po przyjęciu 2 g taksyfoliny wykazała konwersję związku do kwasów 3,4 -dihydroksyfenylooctowego, m-hydroksyfenylooctowego i 3-metoksy-4-hydroksyfenylooctowego. Te same metabolity są wydalane po podaniu doustnym kwercetyny lub DOPA (3,4-dihydroksy-fenyloalaniny) szczurom, królikom lub ludziom. [33] Podobny metabolizm tych związków jest wyjaśnieniem braku toksyczności zarówno kwercetyny jak i dihydrokwercetyny (taksyfoliny).
Wykazano również, że beztlenowa bakteria Clostridium orbiscindens, występująca w ludzkim kale, rozkłada taksyfolinę do kwasu 3,4-dihydroksyfenylooctowego i floroglucyny [34]. Kwas 3,4-dihydroksyfenylooctowy posiada moc silnie redukującą i działanie wychwytujące wolne rodniki [35]. Floroglucyna jest również znana, jako czynnik wychwytujący rodniki [36]. Oba katabolity mogą odgrywać ważną rolę w ogólnym działaniu antyoksydacyjnym światła jelita.
Perspektywy badań nad taksyfoliną
Związek pomiędzy aktywnością i budową taksyfoliny jest nadal przedmiotem badań [31]. Prowadzone są badania nad możliwością ochrony substancji biologicznie czynnych w surowych materiałach poprzez dodanie substancji pochodzenia roślinnego.
Stwierdzono, że soki wzbogacone o taksyfolinę, podaną w postaci preparatu Russlavitol TM (JSC Ametis Company), w dawce 80 mg/kg, posiadają 1.5-krotnie dłuższy czas połowicznego rozpadu antocyjanów w porównaniu do w soku z truskawek. Ponadto maceracja soku w miąższu zawierającym taksyfolinę, w porównaniu z innymi, miała najwyższą zawartość polifenoli i katechin i wyższy potencjał przeciwutleniający (wyższa aktywność DPPH neutralizacji rodników) [32].
Wstępne badania wykazały, w oparciu o teorię Hansch’a, że wartość log P taksyfoliny wynosi 1.82. Log P oznacza współczynnik podziału pomiędzy 1-oktanolem i wodą, jest miarą lipofilności związku. Właściwości 1-oktanolu są podobne do tych, które występują w naturalnych membranach i makrocząsteczkach. Wartość log P jest zbliżona do 2, co sugeruje, że taksyfolina może wnikać do ośrodkowego układu nerwowego, co potwierdza wcześniejsze przenikanie przez barierę krew/mózg. Wyniki te mogą wskazywać na możliwość bezpośredniego, pozytywnego efektu taksyfoliny docierającej do komórek naczyń włosowatych mózgu poprawiając ich funkcje. Modyfikacja bariery krew-mózg zwiększa powodzenie leczenia chorób ośrodkowego układu nerwowego. Jest to obiecujący kierunek badań z wykorzystaniem interakcji leków z syntetycznymi substancjami roślinnymi, które mogą zwiększyć nie tylko skuteczność leczenia raka, ale także chorób neurodegeneracyjnych – choroby Parkinsona i choroby Alzheimera.
Publikacja cytuje 1. Margret I, Moré PD. Taxifolin from Dahurian larch – application for the approval as novel food. Regulation (EC) No 258/97 of the European Parliament and of the Council of 27th January 1997 concerning novel foods and novel food ingredients. 1997, 1-130 2. Tyukavkina NA Lapteva KI, Latina VA, Devyatko NG. Extractive substances of Larix Dahurica. II. Quantitative contents of quercetin and dihydroquercetin. Khimya Prirodnykh Soedinenii 1967, 3(5): 298-301 3. Tyukavkina NA, Lapteva KI, Pentegova, VA. Flavonoids of Larix Dahurica I. Khimiya Prirodnykh Soedinenii 1967, 3(4): 278-279 4. Wolbiś M, Nowak S. Dihydroflavonols from serum reflexum. Acta Polon Pharm 1999, 50: 315-316 5. Kolhir VK, Tyukavkina NA, Bykov VA, et al. Diquertin – new antioxidant and vasoprotector. Chem-Farm J 1995: 61-67 6. Tukavkina NA, Rulenko IA, Kolesnik YA. Natural flavonoids – food antioxidants and biologically active additives. Voprosy Pitaniya 1996: 33-38 7. Habtemariam S. Flavonoids as inhibitors or enhancers of the cytotoxicity of tumor necrosis factor-alpha in L-929 tumor cells. J Nat Prod 1997, 60 (8): 775-778 8. Ratty AK, Sunamoto J, Das NP. Interaction of flavonoids with 1,1-diphenyl-2-picrylhydrazyl free radical, liposomal membranes and soybean lipoxygenase-1. Biochem Pharmacol 1988, 37(6): 989-995 9. Ratty AK, Das NP. Effects of flavonoids on nonenzymatic lipid peroxidation: structure-activity relationship. Biochem Med Metab Biol 1988, 39(1): 69-79 10. Iluchenok TY, Homenko AI, Frigidova LM, et al. Pharmacological and radioprotective properties of some gamma-pyrone derivatives (flavonons and flavonol). Pharmacol Toxicol 1975, 38(5): 607-611 11. Vladutiu GD, Middleton E Jr. Effects of flavonoids on enzyme secretion and endocytosis in normal and mucolipidosis II fibroblasts. Life Sci 1986, 39(8): 717-726 12. Haraguchi H, Ohmi I, Fukuda A, Tamura Y, Mizutani K, Tanaka O, Chou W.H. Inhibition of aldose reductase and sorbitol accumulation by astilbin and taxifolin dihydroflavonols in Engelhardtia chrysolepis. Biosci Biotechnol Biochem 1997, 61(4): 651-654 13. Nanayakkara NP, Hussain RA, Pezzuto JM, Soejarto DD, Kinghorn AD. An intensely sweet dihydroflavonol derivative based on a natural product lead compound. J Med Chem 1988, 31(6): 1250-1253 14. Chu SC, Hsieh YS, Lin JY. Inhibitory effects of flavonoids on Moloney murine leukemia virus reverse transcriptase activity. J Nat Prod 1992,55(2): 179-183 15. Kandaswami C, Perkins E, Drzewiecki G, Soloniuk DS, Middleton E Jr. Differential inhibition of proliferation of human squamous cell carcinoma, gliosarcoma and embryonic fibroblast-like lung cells in culture by plant flavonoids. Anticancer Drugs 1992, 3(5): 525-530 16. Nagao M, Morita N, Yahagi T, Shimizu M, Kuroyanagi M, Fukuoka M, Yoshihira K, Natori S, Fujino T, Sugimura T. Mutagenicities of 61 flavonoids and 11 related compounds. Environ Mutagen 1981, 3(4): 401-419 17. Jurado J, Alejandre-Duran E, Alonso-Moraga A, Pueyo C. Study on the mutagenic activity of 13 bioflavonoids with the Salmonella Ara test. Mutagenesis 1991, 6(4): 289-295 18. Solimani R. Quercetin and DNA in solution: analysis of the dynamics of their interaction with a linear dichroism study. Int J Biol Macromol 1996, 18(4): 287-295 19. Bjeldanes LF, Chang GW. Mutagenic activity of quercetin and related compound. Science 1977, 197(4303): 577-578 20. Biziagos E, Crance JM, Passagot J, Deloince R. Effect of antiviral substances on hepatitis A virus replication in vitro. J Med Virol 1987, 22(1): 57-66 21. Bronner C, Landry Y. Kinetics of the inhibitory effect of flavonoids on histamine secretion from mast cells. Agents Actions 1985, 16(3-4): 147-151 22. Robak J, Gryglewski RJ. Flavonoids are scavenders of superoxide anions. Biochem Pharmacol 1988, 37: 837-842 23. Xie De-Yu, Jackson LA, Cooper JD, Ferreira D, Paiva NL. Molecular and Biochemical Analysis of Two cDNA Clones Encoding Dihydroflavonol-4-Reductase from Medicago truncatula. Plant Physiol 2004, 134(3): 979-994 24. Webb MR, Ebele SE. Comparative analysis of topoisomerase IB inhibition and DNA intercalation by flavonoids and similar compounds: structural determinates of activit. Biochem J 2004, 384(3): 527-541 25. Haraguchi H, Mochida Y, Sakai S, Maruda H, Tamura Y, Mizutani K, Tanaka O, Chou WH. Protection against oxitative damage by dihydroflavonols in Engelhardtia Chrysoepsis. Biosci Biotechnol Biochem 1996. 60 (6): 945-948 26. Kolhir VK, Bykov VA, Teselkin YO, et al. Use of new antioxidant diquertin as an adjuvant in the therapy of patients with acute pneumonia. Phytotherapy Research 1998, 12: 606-608 27. Haraguchi H, Tamura Y, Mizutani K, Tanaka O, Chou WH. Inhibition of adose reductase and sorbitol accumulation by astilbin and taxifoln dihydrofavonols in Engelhardtia Chrysolepsis. J Med 1998, 31 (6): 1250-1253 28. Grimm T, Skrabala R, Chovanová Z, Muchová J, Sumegová K, Liptáková A, Ďuračková Z, Högger P. Single and multiple dose pharmacokinetics of maritime pine bark extract (Pycnogenol) after oral administration to healthy volunteers. BMC Clin Pharmacol 2006, 6(4): 1-12 29. Kozłow W, Azizow G, Britow A, Gurowa OA. Kapilar w korekcji mikrocyrkulatornych rasstroistw. Vracz 2006, 6: 1-5 30. Bobrowska B, Tokarz A, Grynkiewicz G. Rola składników diety w rozwoju procesu nowotworowego indukowanego 7,12-dimetylobenzantracenem u szczurów. Bromat Chem Toksykol XLII, 2009, 3: 1017-1023 31. Teixeira S, Siquet Ch, Alves C, Boal I, Marques P, Borges F, Lima JFC, Reis S. Strucure-property studies on the antioxidant activity of flavonoids present in diet. Free Rad Biol Med 2005, 39(8): 1099-1108 32. Kalisz S. Wpływ sposobu otrzymywania soków truskawkowych na zawartość antocyjanów i barwę. Żywn Nauk Technol Jakość 2008, 5(60): 149–160 33. Booth AN, De Eds F. The toxicity and Metabolism of Dihydroquercetin. J Am Pharmaceut Assoc 1957, XLVII(3): 183-184 34. Schoefer L, Mohan R, Schwiertz A, et al. Anaerobic degradation of flavonoids by Clostridium orbiscindens. Appl Environ Microbiol 2003, 69(10): 5849-5854 35. Jaganath IB, Mullen W, Lean ME, Edwards CA, Crozier A. In vitro catabolism of rutin by human fecal bacteria and the antioxidant capacity of its catabolites. Free Radic Biol Med 2009, 47(8): 1180-1189 36. Nenadis N, Wang LF, Tsimidou M, Zhang HY. Estimation of scavenging activity of phenolic compounds using the ABTS(*+) assay. J Agric Food Chem 2004, 52(15): 4669-4674
Źródła pbn.nauka.gov.pl/polindex-webapp/browse/article/article-f5a1c8fa-8989-4e8d-bb1a-6f6e571a858f forum.gazeta.pl/forum/w,26140,156541667,156541667,Witamina_P_Bajkalska_Taksyfolina_.html#p156764420 forum-onkologiczne.com.pl/forum/prosze-o-rade-vt8562,15.htm#221109

Sprawdź proponowane artykuły